李磊研究组建立了一种新型活化态多能干细胞
哺乳动物早期胚胎发育是一个动态且复杂的过程,而胚胎着床后在子宫内的发育进一步增加了其研究难度。自上世纪八十年代第一株小鼠的胚胎干细胞(Embryonic Stem Cells, ESCs)建立以来,包括人类胚胎干细胞在内的多种类型的干细胞相继建立,为研究哺乳动物早期胚胎发育及干细胞临床应用提供可能。之后的研究表明在2i与Lif条件下培养的小鼠ESCs处于原始(naive)态,该状态的ESCs需要脱离原始态后方能应答谱系分化的诱导信号;而小鼠的上胚层干细胞(Epiblast Stem Cells, EpiSCs)则处于始发(primed)态,它们的命运已经被部分决定。大量研究表明,哺乳动物胚胎着床以后到原肠运动(gastrulation)之前的上胚层细胞,可以直接响应三胚层细胞和原始生殖细胞分化的诱导信号,具有多能性。最近科学家提出假说:哺乳动物体内具有多潜能特性的上胚层细胞可能介于原始态和始发态之间的中间状态,即活化/塑型/形成(formative)态,该状态的建立是原肠运动和早期细胞谱系形成的关键。活化态多能干细胞的特性及其体外长期维持,对哺乳动物早期胚胎发育研究及干细胞临床应用至关重要,是相关领域亟需解决的重大科学问题。
2021年2月19日,中国科学院动物研究所李磊实验室与清华大学颉伟实验室在《Cell Research》杂志在线发表题为“Formative pluripotent stem cells show features of epiblast cells poised for gastrulation”的工作。他们通过三维(3D)培养模拟体内胚胎发育环境,配合Activin和Fgf信号通路的激活,分化初始态胚胎干细胞,首先建立了小鼠类上胚层结构(Epiblastoids);后通过抑制Wnt信号通路,实现了这种类上胚层结构的长期培养。长期培养的类上胚层结构具有科学家推测的活化态特征,因此被命名为活化态多能干细胞(Formative pluripotent stem cells,fPSCs)。fPSCs在形态上类似于着床之后的上胚层细胞,形成具有极性的花环样结构,还可从小鼠iPSCs和E5.5-6.5上胚层细胞建立而来(图1a),并能在不添加ROCK抑制剂的情况下进行单细胞传代。在转录组水平上,fPSCs与小鼠原肠运动起始前的上胚层细胞相似(E5.5-6.5),高表达formative标志基因,而naive和primed基因则处于相对较低的表达水平。在单细胞转录组水平上,fPSCs细胞群体相对比较均质。在表观组上,fPSCs与小鼠原肠运动即将起始前(E6.5)的上胚层细胞相似,富含超级共价修饰基因(super-bivalency gene),特别在很多重要功能基因的启动子区域的表观修饰。在分化潜能上,fPSCs在体外可快速高效地分化成三胚层前体细胞,同时能有效分化形成原始生殖细胞;fPSCs单细胞注射到小鼠囊胚腔内后,可掺入内细胞团,并持续存在于卵柱期胚胎中,畸胎瘤实验表明fPSCs能有效形成三胚层细胞(图1b-d)。总之,该研究报道了一种具有原肠运动即将起始前的上胚层细胞特性的活化态多能干细胞。
有趣的是,近期世界多个实验室先后报道了多个具有formative特征的细胞系,包括RSCs (Rosette-like Stem Cells)、XPSCs (Χiμαιρα Pluripotent Stem Cells)和FS细胞(Formative Stem cells)(参考文献)。其中RSCs和XPSCs更接近围植入期上胚层细胞,FS细胞和fPSCs更接近原肠运动前的上胚层细胞,而fPSCs在表观组上最接近原肠运动即将起始前的上胚层细胞(图1e)。深入研究这些细胞的异同和分化特性,将极大推动对哺乳动物早期胚胎发育的理解,同时促进多能干细胞的临床应用。
中国科学院动物研究所王晓晓和余洋,以及重庆医科大学向云龙为本文的共同第一作者,中国科学院动物研究所李磊研究员和清华大学生命科学学院颉伟教授共同通讯作者。此外,中国科学院广州健康研究院和上海生化所景乃禾实验室、中国科学院动物研究所王红梅实验室和黄仕强实验室参与该工作。该项目得到国家重点研发计划和国家基金委等项目的支持。
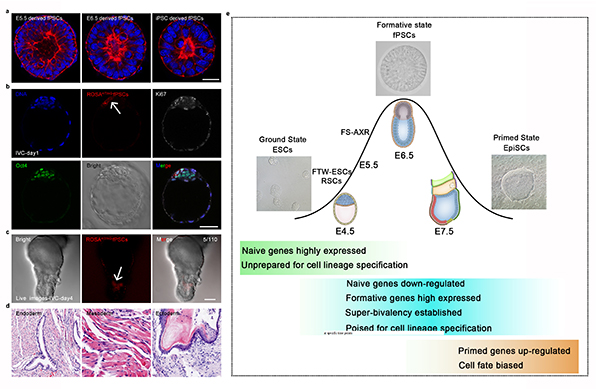
图1. fPSC derivation from in vivo epiblasts and differentiation in vivo.
原文链接:
https://doi.org/10.1038/s41422-021-00477-x
参考文献:
Kinoshita, M., Barber, M., Mansfield, W., Cui, Y., Spindlow, D., Stirparo, G.G., Dietmann, S., Nichols, J., and Smith, A. (2020). Capture of Mouse and Human Stem Cells with Features of Formative Pluripotency. Cell Stem Cell, https://doi.org/10.1016/j.stem.2020.1011.1005.
Yu, L., Wei, Y., Sun, H.X., Mahdi, A.K., Pinzon Arteaga, C.A., Sakurai, M., Schmitz, D.A., Zheng, C., Ballard, E.D., Li, J., et al. (2020). Derivation of Intermediate Pluripotent Stem Cells Amenable to Primordial Germ Cell Specification. Cell Stem Cell, https://doi.org/10.1016/j.stem.2020.1011.1003.
Neagu, A., van Genderen, E., Escudero, I., Verwegen, L., Kurek, D., Lehmann, J., Stel, J., Dirks, R.A.M., van Mierlo, G., Maas, A., et al. (2020). In vitro capture and characterization of embryonic rosette-stage pluripotency between naive and primed states. Nat Cell Biol 22, 534-545.
人类活动和气候变化加速生物多样性的减少,导致物种范围的转移、收缩和扩张。在全球范围内,人类活动和气候变化已对生物多样性构成了严重威胁,目前已导致全球522种灵长类动物中约68%的物种面临灭绝风险。
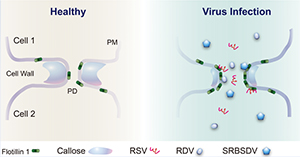
植物病毒素有“植物顽疾”之称,每年引起全球作物经济损失高达4000亿元。水稻作为人类重要的粮食作物之一,供给全世界一半以上的人口,主要种植于亚洲、非洲和南美洲等地区。

