王红梅/郭帆/吴军/蒋祥祥团队绘制灵长类胚胎原肠运动至早期器官发育转录组图谱
人的生命开始于精子与卵子融合形成受精卵(胚胎期第0天;Embryonic day 0;E0),受精卵经历卵裂形成囊胚,囊胚在E7左右种植到母体子宫进一步发育。E14开始,胚胎经历原肠运动,胚胎后部细胞发生大规模定向迁移,并形成原条细胞。原条细胞进一步分化为中胚层和定型内胚层(definitive endoderm),同时胚胎前部细胞分化为外胚层。基于此,胚胎发育成为具有内胚层、中胚层和外胚层的三胚层胚胎。经过复杂的信号通路调控,三胚层胚胎进一步形成各种器官原基,并最终形成我们身体中包括神经系统、消化系统、呼吸系统、心血管循环系统、泌尿生殖系统等所有系统的各种器官。原肠运动和三胚层分化异常与多种出生缺陷(如先天性心脏病和神经管畸形等)和发育源性疾病相关。了解人类早期胚胎发育过程及其机制对于这些疾病的诊断和治疗至关重要。为了精准地描述不同发育时期人类胚胎特征并进行物种间胚胎发育比较,自上世纪早期来自美国卡耐基研究所的Franklin Mall等人将人类胚胎发育的前60天(E0-E60)划分为23个发育时期,即Carnegie stage(CS1-CS23)[1]。目前,通过体外胚胎培养等方法,人类CS1-CS6(E0-E14)胚胎发育事件已被多个团队解析[2-5];借助一枚宝贵的在体胚胎,人类CS7胚胎的关键发育事件(原肠运动等)也开始被阐明[6],然而,由于临床诊疗规范限制,人CS8-11的正常胚胎极难获得,所以在此阶段发生的中晚期原肠运动和早期器官发育事件相关研究仍为空白。非人灵长类(如食蟹猴)在进化、生理特征及胚胎发育方面与人类高度类似,可作为研究人类早期胚胎发育的替代模型。由于人类早期胚胎难于获得,一些人类早期胚胎上难以回答的问题可借助非人灵长类胚胎实现。
2022年12月14日,中国科学院动物研究所王红梅和郭帆团队、美国德克萨斯大学西南医学中心吴军团队以及安徽医科大学蒋祥祥团队合作(中国科学院动物研究所博士后翟晶磊、博士生郭敬、助理研究员万海峰、博士生齐鲁青和德克萨斯大学西南医学中心的博士后刘立中为本文共同第一作者)在Nature上发表了文章Primate gastrulation and early organogenesis at single-cell resolution[7]。研究者以食蟹猴为模型,利用单细胞转录组测序和干细胞分化模型等,绘制了食蟹猴CS8-CS11时期(E20-E29)胚胎的单细胞转录组图谱,揭示了原肠运动和三胚层分化(神经管、体节、肠管等的发育)过程中重要细胞类群的特征及其谱系发生和调控机制,并比较了啮齿类和灵长类早期胚胎发育事件的进化差异。
研究者收集了CS8-CS11阶段的食蟹猴胚胎,利用10X单细胞转录组测序技术捕获了56636个单细胞并进行生物信息学分析,明确定义了食蟹猴该时期的38个主要细胞类群,绘制了目前国际上第一张灵长类CS8-CS11胚胎的高通量单细胞转录组图谱(图1)。
啮齿类动物(小鼠)原肠运动阶段的胚胎三胚层细胞分化过程已有相对全面清晰的描述,但在灵长类动物上的研究仍非常有限。为了研究灵长类原肠运动阶段胚胎三胚层细胞分化的精细过程,研究者通过RNA轨迹分析描绘了原条细胞的三向分化潜能,分别为初始中胚层(nascent mesoderm)、定型内胚层和原结(node)。其中,初始中胚层可进一步分化为神经中胚层祖细胞(neuromesoderm progenitor, NMP)、前体节中胚层(presomite mesoderm, PSM)、轴旁中胚层(paraxial mesoderm)、中间中胚层(intermediate mesoderm)、侧板中胚层(lateral plate mesoderm)、生心中胚层(cardiac mesoderm)和胚外中胚层(extraembryonic mesoderm)等细胞类型;定型内胚层与原肠运动之前形成的脏壁内胚层(visceral endoderm)共同贡献于肠管(gut tube)的形成;原结进一步参与轴正中中胚层(axial mesoderm)的形成。此外,研究者基于生物信息学分析推测,由外胚层分化而来的神经管前后不对称和背腹不对称的发育模式是由WNT、SHH和TGB-β等信号在胚胎前后轴和背腹轴的不对称表达所介导的。
哺乳动物早期胚胎发育过程在进化上高度保守,但不同物种哺乳动物的早期胚胎发育过程仍存在特异的分子特征。研究者全面比较了相同发育阶段的小鼠和食蟹猴胚胎的转录组差异(图3),揭示了两物种胚胎中对应细胞类型的分化调控异同。研究发现,T、EOMES和TBX6基因在小鼠和食蟹猴的原条、初始中胚层、神经中胚层祖细胞和外胚层细胞中的表达模式不同。此外,与小鼠相比,Hippo信号通路的多个下游基因在食蟹猴的NMP/PSM中被显著上调。为深入研究Hippo信号通路在灵长类动物与啮齿类动物NMP/PSM形成过程中的不同作用,研究者构建了人、猴和小鼠胚胎干细胞诱导产生的NMP/PSM体外模型,通过添加抑制剂等实验,发现Hippo信号通路在灵长类NMP/PSM细胞仍保持高度活化状态,而在小鼠NMP/PSM细胞中被抑制(图3)。由此推测Hippo信号通路在人和猴NMP/PSM细胞中的高度活化状态可能与灵长类胚胎体轴更长、胚胎体积更大及发育周期更长等体征密切相关。
基于干细胞的人类胚胎模型(类胚胎)对于研究人胚胎早期发育研究至关重要。近年来,类原肠胚[8,9]、类神经胚[10-13]、心脏类器官[14]以及类体节[15]模型相继构建成功。然而,由于缺乏灵长类动物体内相应时期胚胎的发育数据,这些胚胎模型对在体真实胚胎的模拟程度无法被直接证实。本研究填补了这一空白,为未来相应时期胚胎模型的构建提供了在体的比对数据。并且,研究者利用这一在体数据,初步研究了上述胚胎模型与在体胚胎的相似度,发现上述胚胎模型在细胞类型方面与在体胚胎存在一定相似性,但在关键信号通路激活程度、转录因子表达等多方面与在体胚胎存在差异。
综上所述,本研究揭示了灵长类动物原肠运动至早期器官发育阶段胚胎的细胞组分与分子特征、细胞谱系发生过程及分子调控机制。该研究不仅填补了灵长类胚胎原肠运动至早期器官发育阶段的领域知识空白,而且为人类胚胎模型的研究提供了必要的在体数据参考,为深入了解人类早期胚胎发育过程的调控机理以及发育异常相关疾病的病理奠定坚实基础。
原文链接:https://www.nature.com/articles/s41586-022-05526-y
参考文献:
1. O’Rahilly, R. & Müller, F. Developmental stages in human embryos : including a revision of Streeter’s. In: "Horizons" and a Survey of the Carnegie Collection. Section1, Page 2-3. (Carnegie Institution of Washington, 1987)
2. Deglincerti, A., Croft, G. F., Pietila, L. N., Zernicka-Goetz, M., Siggia, E. D., & Brivanlou, A. H. Self-organization of the in vitro attached human embryo. Nature 533, 251-254 (2016)
3. Shahbazi, M. N., Jedrusik, A., Vuoristo, S., Recher, G., Hupalowska, A., Bolton, V., Fogarty, N. N. M., Campbell, A., Devito, L., Ilic, D., Khalaf, Y., Niakan, K. K., Fishel, S., & Zernicka-Goetz, M. Self-organization of the human embryo in the absence of maternal tissues. Nat Cell Biol. 18, 700-708 (2016)
4. Xiang, L., Yin, Y., Zheng, Y., Ma, Y., Li, Y., Zhao, Z., Guo, J., Ai, Z., Niu, Y., Duan, K., He, J., Ren, S., Wu, D., Bai, Y., Shang, Z., Dai, X., Ji, W., & Li, T. A developmental landscape of 3D-cultured human pre-gastrulation embryos. Nature 577, 537-542 (2020)
5. Zhou, F., Wang, R., Yuan, P., Ren, Y., Mao, Y., Li, R., Lian, Y., Li, J., Wen, L., Yan, L., Qiao, J., & Tang, F. Reconstituting the transcriptome and DNA methylome landscapes of human implantation. Nature, 572, 660-664 (2019)
6. Tyser, R. C. V., Mahammadov, E., Nakanoh, S., Vallier, L., Scialdone, A., & Srinivas, S. Single-cell transcriptomic characterization of a gastrulating human embryo. Nature 600, 285-289 (2021)
7. Primate gastrulation and early organogenesis at single-cell resolution (Prepare for publication)
8. Minn, K. T. et al. High-resolution transcriptional and morphogenetic profiling of cells from micropatterned human ESC gastruloid cul tures. eLife 9, e59445 (2020).
9. Minn, K. T., Dietmann, S., Waye, S. E., Morris, S. A. & Solnica-Krezel, L. Gene expression dynamics underlying cell fate emergence in 2D micropatterned human embryonic stem cell gastruloids. Stem Cell Rep. 16, 1210–1227 (2021).
10. Rifes, P. et al. Modeling neural tube development by differentiation of human embryonic stem cells in a microfluidic WNT gradient. Nat. Biotechnol. 38, 1265–1273 (2020).
11. Haremaki, T. et al. Self-organizing neuruloids model developmental aspects of Huntington’s disease in the ectodermal compartment. Nat. Biotechnol. 37, 1198–1208 (2019).
12. Karzbrun, E. et al. Human neural tube morphogenesis in vitro by geometric constraints. Nature 599, 268–272 (2021).
13. De Santis, R., Etoc, F., Rosado-Olivieri, E. A. & Brivanlou, A. H. Self-organization of human dorsal-ventral forebrain structures by li ght induced SHH. Nat. Commun. 12, 6768 (2021).
14. Drakhlis, L. et al. Human heart-forming organoids recapitulate early heart and foregut development. Nat. Biotechnol. 39, 737–746 (2021).
15. Sanaki-Matsumiya, M. et al. Periodic formation of epithelial somites from human pluripotent stem cells. Nat. Commun. 13, 2325 (2022).
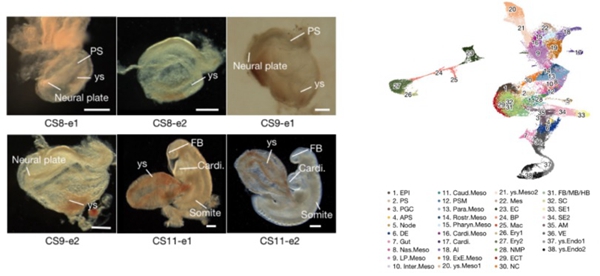
图1. CS8-CS11时期食蟹猴胚胎的明场图(左)与38种主要细胞类群(右)
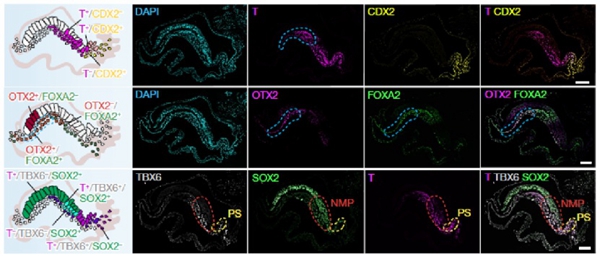
图2. E22胚胎原条及其衍生物细胞类型分布示意图与免疫荧光图
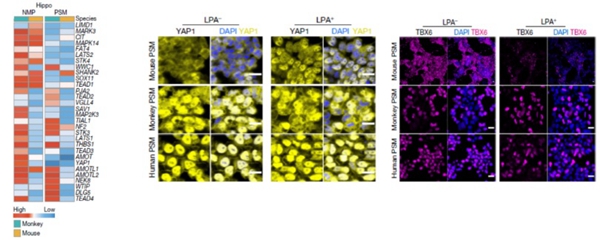
图3. Hippo信号通路在灵长类与啮齿类NMP/PSM细胞的活化程度差异。
食蟹猴和小鼠Hippo信号通路差异基因表达模式(左);抑制Hippo信号通路对人、猴和小鼠PSM中YAP1分子表达的影响(中)及对人、猴、小鼠PSM分化的影响(右)。
人类活动和气候变化加速生物多样性的减少,导致物种范围的转移、收缩和扩张。在全球范围内,人类活动和气候变化已对生物多样性构成了严重威胁,目前已导致全球522种灵长类动物中约68%的物种面临灭绝风险。
植物病毒素有“植物顽疾”之称,每年引起全球作物经济损失高达4000亿元。水稻作为人类重要的粮食作物之一,供给全世界一半以上的人口,主要种植于亚洲、非洲和南美洲等地区。

